V časných ranních hodinách 29. prosince zveřejnil NEJM online novou klinickou studii fáze III o novém čínském koronaviru VV116. Výsledky ukázaly, že VV116 nebyl z hlediska délky klinického zotavení horší než Paxlovid (nematovir/ritonavir) a měl méně nežádoucích účinků.
Zdroj obrázku:NEJM
Medián doby zotavení 4 dny, míra nežádoucích účinků 67,4 %
VV116 je perorální nukleosidový lék proti novému koronaviru (SARS-CoV-2) vyvinutý ve spolupráci se společnostmi Junsit a Wang Shan Wang Shui. Je to inhibitor RdRp společně s remdesivirem od společnosti Gilead, molnupiravirem od společnosti Merck Sharp & Dohme a azelvudinem od společnosti Real Biologics.
V roce 2021 byla v Uzbekistánu dokončena fáze II klinické studie přípravku VV116. Výsledky studie ukázaly, že skupina léčená přípravkem VV116 dokázala lépe zlepšit klinické příznaky a významně snížit riziko progrese do kritické formy a úmrtí ve srovnání s kontrolní skupinou. Na základě pozitivních výsledků této studie byl přípravek VV116 v Uzbekistánu schválen k léčbě pacientů se středně těžkým až těžkým onemocněním COVID-19 a stal se prvním novým perorálním lékem na koronární onemocnění schváleným k uvedení na trh v Číně [1].
Tato klinická studie fáze III[2] (NCT05341609), vedená prof. Zhao Renem ze Šanghajské nemocnice Ruijin, prof. Gaoyuanem ze Šanghajské nemocnice Renji a akademikem Ning Guangem ze Šanghajské nemocnice Ruijin, byla dokončena během epidemie způsobené variantou Omicron (B.1.1.529) od března do května v Šanghaji. Cílem bylo vyhodnotit účinnost a bezpečnost VV116 oproti Paxlovidu pro včasnou léčbu pacientů s mírným až středně těžkým průběhem COVID-19. Cílem bylo vyhodnotit účinnost a bezpečnost VV116 oproti Paxlovidu pro včasnou léčbu pacientů s mírným až středně těžkým průběhem COVID-19.
Zdroj obrázku: Reference 2
V období od 4. dubna do 2. května 2022 byla provedena multicentrická, pro pozorovatele zaslepená, randomizovaná, kontrolovaná studie s 822 dospělými pacienty s onemocněním Covid-19 s vysokým rizikem progrese a s mírnými až středně těžkými příznaky. Cílem bylo posoudit způsobilost účastníků ze sedmi nemocnic v čínské Šanghaji. Nakonec 771 účastníků dostalo buď VV116 (384, 600 mg každých 12 hodin v den 1 a 300 mg každých 12 hodin ve dnech 2-5), nebo Paxovid (387, 300 mg nimatuviru + 100 mg ritonaviru každých 12 hodin po dobu 5 dnů) jako perorální lék.
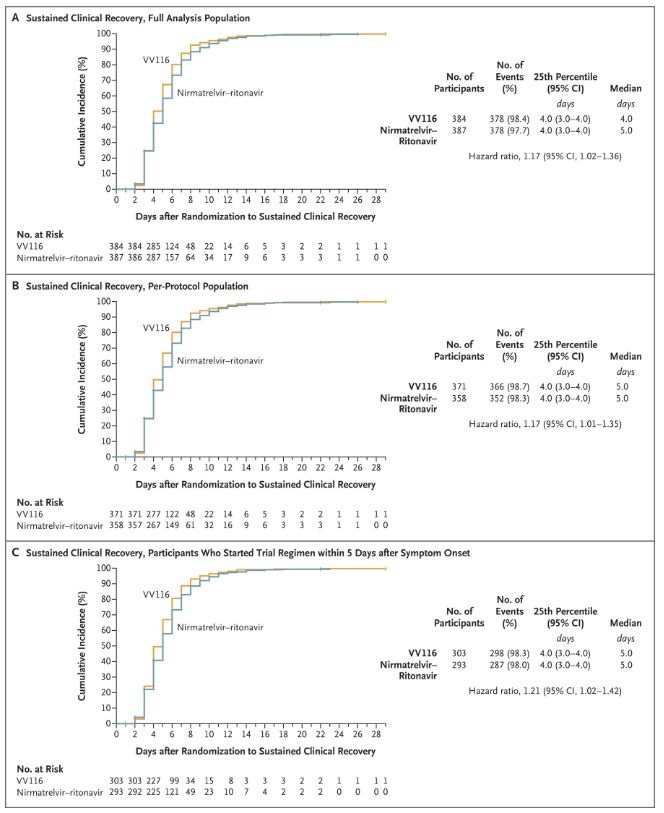
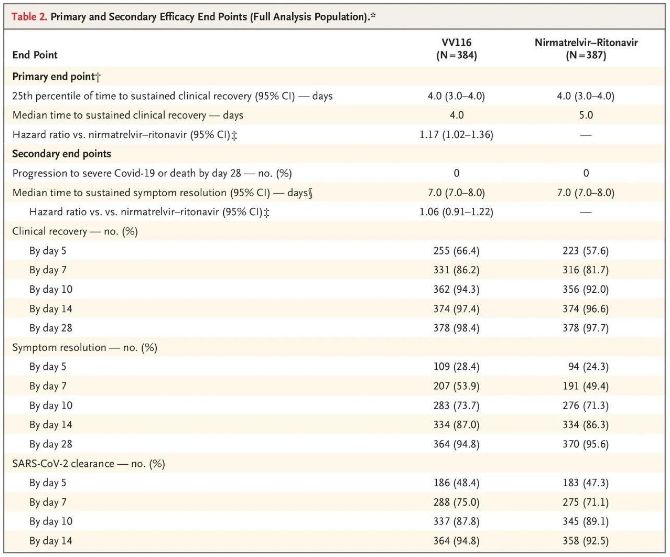
Výsledky této klinické studie ukázaly, že včasná léčba mírného až středně těžkého onemocnění COVID-19 vakcínou VV116 splnila primární cílový parametr (doba do trvalého klinického zotavení) předpokládaný klinickým protokolem: medián doby do klinického zotavení byl 4 dny ve skupině s VV116 a 5 dní ve skupině s Paxlovidem (poměr rizik 1,17; 95% interval spolehlivosti 1,02 až 1,36; dolní hranice >0,8).
Udržování doby klinické rekonvalescence
Primární a sekundární cílové parametry účinnosti (komplexní analýza populace)
Zdroj obrázku: Reference 2
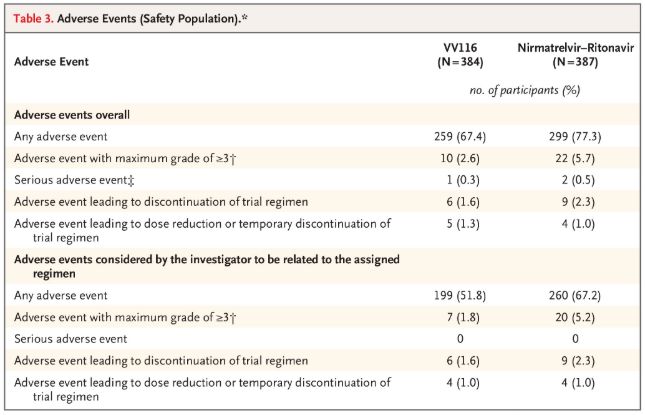
Pokud jde o bezpečnost, účastníci užívající VV116 hlásili po 28denním sledování méně nežádoucích účinků (67,4 %) než účastníci užívající Paxlovid (77,3 %) a výskyt nežádoucích účinků 3./4. stupně byl nižší u VV116 (2,6 %) než u Paxlovidu (5,7 %).
Nežádoucí účinky (bezpečné osoby)
Zdroj obrázku: Reference 2
Kontroverze a otázky
Dne 23. května 2022 společnost Juniper oznámila, že registrační klinická studie fáze III srovnávající přípravek VV116 s přípravkem PAXLOVID pro časnou léčbu mírného až středně těžkého onemocnění COVID-19 (NCT05341609) splnila svůj primární cílový ukazatel studie.
Zdroj obrázku: Reference 1
V době, kdy chyběly podrobnosti o studii, byla kontroverze kolem studie fáze III dvojí: zaprvé se jednalo o jednoduše zaslepenou studii a vzhledem k absenci placebové kontroly panovaly obavy, že by bylo obtížné lék zcela objektivně posoudit; zadruhé existovaly otázky ohledně klinických cílových parametrů.
Klinická kritéria pro zařazení do studie přípravku Juniper jsou (i) pozitivní výsledky nového testu na koronavir, (ii) jeden nebo více mírných nebo středně závažných příznaků COVID-19 a (iii) pacienti s vysokým rizikem závažného průběhu COVID-19, včetně úmrtí. Jediným primárním klinickým cílovým ukazatelem je však „doba do trvalého klinického zotavení“.
Těsně před oznámením, 14. května, společnost Juniper revidovala klinické cílové parametry odstraněním jednoho z primárních klinických cílových parametrů, „podílu konverzí k vážnému onemocnění nebo úmrtí“ [3].
Zdroj obrázku: Reference 1
Těmito dvěma hlavními spornými body se publikovaná studie také konkrétně zabývala.
Vzhledem k náhlému rozšíření přípravku Omicron nebyla výroba placebových tablet pro Paxlovid dokončena před zahájením studie, a proto výzkumníci nemohli provést tuto studii s dvojitě zaslepeným, dvojitě simulovaným designem. Pokud jde o jednoduše zaslepený aspekt klinické studie, Juniper uvedl, že protokol byl proveden po komunikaci s regulačními orgány a že jednoduše zaslepený design znamená, že ani výzkumník (včetně hodnotitele sledovaného parametru studie), ani sponzor nebudou znát konkrétní terapeutické přidělení léku, dokud nebude na konci studie uzamčena finální databáze.
Až do doby závěrečné analýzy u žádného z účastníků studie nedošlo k úmrtí ani progresi do závažného onemocnění Covid-19, takže nelze vyvodit žádné závěry o účinnosti přípravku VV116 v prevenci progrese do závažného nebo kritického onemocnění Covid-19 nebo úmrtí. Data naznačují, že odhadovaná střední doba od randomizace do trvalé regrese cílových symptomů souvisejících s Covid-19 byla v obou skupinách 7 dní (95% interval spolehlivosti, 7 až 8) (poměr rizik, 1,06; 95% interval spolehlivosti, 0,91 až 1,22) [2]. Není těžké vysvětlit, proč byl primární cílový parametr „míra konverze do závažného onemocnění nebo úmrtí“, který byl původně stanoven před koncem studie, odstraněn.
Dne 18. května 2022 časopis Emerging Microbes & Infections publikoval výsledky první klinické studie VV116 u pacientů infikovaných variantou Omicron [4], což byla otevřená, prospektivní kohortová studie se 136 potvrzenými hospitalizovanými pacienty.
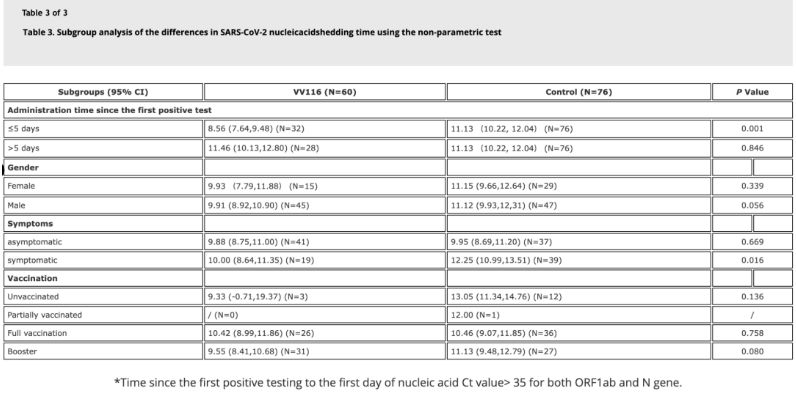
Data ze studie ukázala, že pacienti s infekcí virem Omicron, kteří použili VV116 do 5 dnů od prvního pozitivního testu na nukleovou kyselinu, měli dobu do regrese nukleové kyseliny 8,56 dne, což je méně než 11,13 dne v kontrolní skupině. Podávání VV116 symptomatickým pacientům v časovém rámci této studie (2–10 dnů od prvního pozitivního testu na nukleovou kyselinu) zkrátilo dobu do regrese nukleové kyseliny u všech pacientů. Z hlediska bezpečnosti léčiva nebyly ve skupině léčené VV116 pozorovány žádné závažné nežádoucí účinky.
Zdroj obrázku: Reference 4
Probíhají tři klinické studie přípravku VV116, z nichž dvě jsou studie fáze III u pacientů s mírným až středně těžkým průběhem COVID-19 (NCT05242042, NCT05582629). Druhá studie u pacientů s středně těžkým až těžkým průběhem COVID-19 je mezinárodní multicentrická, randomizovaná, dvojitě zaslepená klinická studie fáze III (NCT05279235), která hodnotí účinnost a bezpečnost přípravku VV116 ve srovnání se standardní léčbou. Podle oznámení společnosti Juniper byl první pacient zařazen do studie a dávka mu byla podána v březnu 2022.
Zdroj obrázku: clinicaltrials.gov
Reference:
[1]Junshi Biotech: Oznámení o hlavním cílovém ukazateli registrované klinické studie fáze III porovnávající VV116 s PAXLOVIDEM pro časnou léčbu mírného až středně těžkého onemocnění COVID-19
[2]https://www.nejm.org/doi/full/10.1056/NEJMoa2208822?query=featured_home[3]https://clinicaltrials.gov/ct2/show/record/NCT05341609[4] Ensi Ma, Jingwen Ai, Jian Yi Zhangu Hao Yin, Zhiren Fu, Hao Xing, Li Li, Liying Sun, Heyu Huang, Quanbao Zhang, Linlin Xu, Yanting Jin, Rui Chen, Guoyue Lv, Zhijun Zhu, Wenhong Zhang, Zhengxin Wang. (2022) Profil Omikronové infekce a stav očkování mezi 1881 příjemci transplantátu jater: multicentrická retrospektivní kohorta. Emerging Microbes & Infections 11:1, strany 2636-2644.
Čas zveřejnění: 6. ledna 2023
 中文网站
中文网站